Contenido principal
Alfa 38
Revolución permanente en la lucha contra el cáncer
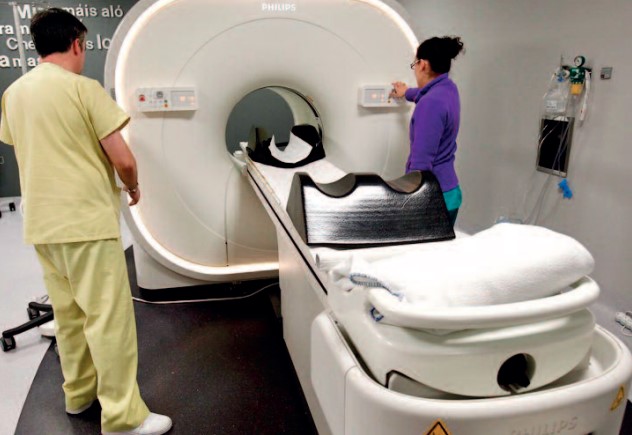
El uso de isótopos radioactivos para el diagnóstico y tratamiento de patologías ha cambiado la forma en la que nos enfrentamos al cáncer. Hablamos de la medicina nuclear, un campo con décadas de historia que hoy trabaja para ser cada vez más efectiva e inocua. Buena prueba del éxito de la medicina nuclear está en su relevancia clínica actual: se calcula que una de cada dos personas se beneficiará de ella a lo largo de su vida.
Texto: Sergio Ferrer | Periodista
A finales de la década de los cuarenta, el doctor Carlos Blanco Soler mostró interés en las posibilidades de un nuevo campo: la medicina nuclear. En 1949, junto con otros colaboradores del Hospital de la Cruz Roja de Madrid, importó desde Reino Unido un detector de radiaciones y yodo-131. El objetivo era diagnosticar y tratar enfermedades tiroideas. En septiembre de ese mismo año, un paciente con hipertiroidismo era inoculado con el isótopo radioactivo, y, casi 60 años después, el desarrollo de nuevos equipos y radiofármacos ha revolucionado especialidades como la oncología.
Pero, ¿en qué consiste la ‘medicina nuclear’? Este es el nombre que recibe la rama de la medicina que emplea pequeñas cantidades de material radiactivo para el diagnóstico y tratamiento de enfermedades. Para conseguirlo, une radioisótopos, como flúor-18 y carbono-11, a un fármaco que lo transporta al interior del cuerpo a través del torrente sanguíneo. Este radiofármaco recorre el organismo hasta alcanzar el órgano de interés, donde es ‘fotografiado’ por un detector de radiación. El resultado final es una imagen que muestra cómo funciona la estructura… y qué falla en ella.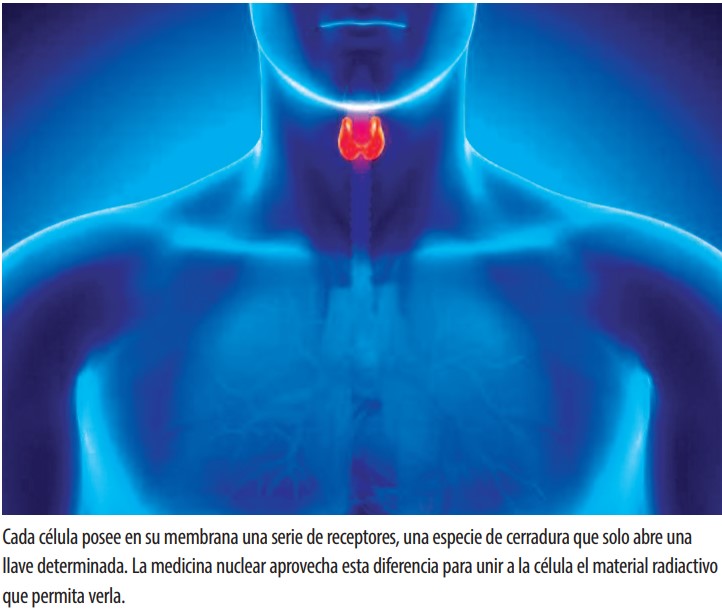
La medicina nuclear fue conocida hasta los años 50 como ‘medicina atómica’. Hoy se la conoce también como ‘imagen molecular’. El director de medicina nuclear de la Clínica Universidad de Navarra, José Ángel Richter, explica sus bases: “En lugar de atravesar al paciente con un rayo X o un campo magnético para ver estructuras anatómicas, usamos fármacos marcados para ver la actividad metabólica de los procesos”.
En otras palabras, en vez de ver lo que ocurre dentro de células y tejidos, la medicina nuclear nos permite echar un vistazo a lo que sucede en las moléculas de esas células. En España se pusieron en marcha los primeros centros de medicina nuclear en la década de los cincuenta y hoy existen unas 150 unidades de esta especialidad, que al año llevan a cabo 700.000 diagnósticos y 30.000 aplicaciones terapéuticas.
¿Diagnóstico o tratamiento?
Cada tipo de célula tiene en su membrana una serie de receptores, ‘cerraduras’ en las que solo encaja un tipo de ‘llave’. La medicina nuclear aprovecha estas diferencias para unir a la célula de interés el material radiactivo que nos permitirá verla o, si es cancerígena, matarla. El radiofármaco se inyecta en el torrente sanguíneo y va circulando por el organismo: cada vez que pasa por el órgano en cuestión se fija poco a poco en esa parte. El material radioactivo varía según se busque el diagnóstico o el tratamiento. “Para el diagnóstico se usan isótopos radioactivos de muy baja energía, normalmente gamma”, explica el presidente de la Sociedad Española de Medicina Nuclear e Imagen Molecular (SEMNIM) y médico del Hospital Universitario Reina Sofía (Córdoba), Juan Antonio Vallejo. Si lo que queremos es tratar al paciente la estrategia es similar. En este caso, el isótopo que ‘mandamos’ a la célula “es una emisión beta negativa en forma de electrones o una emisión alfa en forma de partículas grandes que dañen a la célula”. La finalidad es la misma: radiar solo a la célula que queremos eliminar. Así lesionaremos su ADN, generando radicales libres que terminen por destruirla.
Marcando células con gammagrafía
La técnica de diagnóstico convencional en medicina nuclear es la ‘gammagrafía’, cuyo primer escáner con cristal de centelleo de yoduro sódico se fabricó en 1951. Hoy en día ha evolucionado hasta recibir el nombre de Single Photon Emission Computed Tomography (Tomografía Computerizada de Emisión Monofotónica, SPECT por sus siglas en inglés). Como su nombre indica, utiliza la radiación gamma emitida por el isótopo radiactivo para obtener una imagen del paciente. “Existe una gran diversidad de procedimientos con esta técnica”, dice Richter. “Es muy importante para el estudio de la función de órganos como el riñón, estructuras anatómicas como el esqueleto y el aparato digestivo”.
El marcaje de células es otra posibilidad que nos ofrece la gammagrafía convencional. De esta forma, el médico puede ver cómo leucocitos, plaquetas, hematíes y otros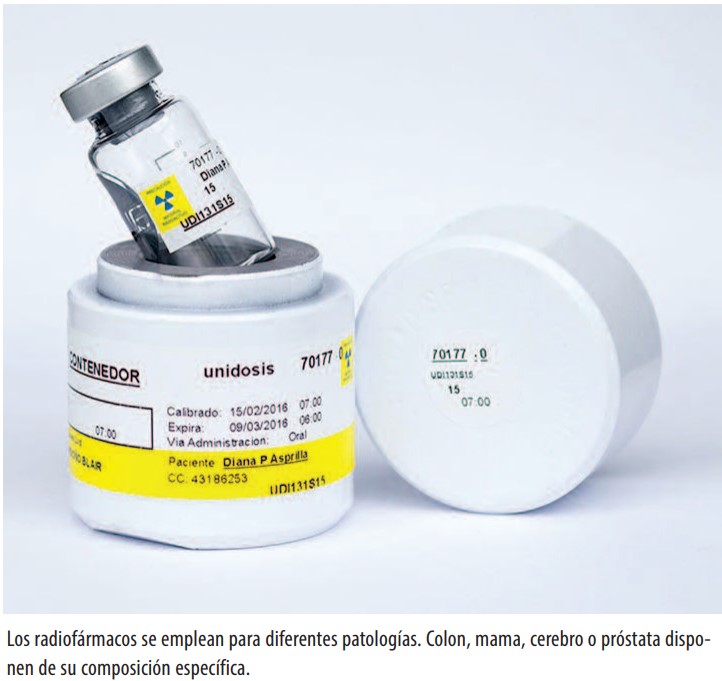 tipos de célula se comportan dentro de una persona, ya sea de una forma normal o patológica. “Hay pacientes que tienen trastornos en estas células y, de esta forma, podemos ver si se están produciendo en alguna zona concreta del cuerpo”, añade Richter.
tipos de célula se comportan dentro de una persona, ya sea de una forma normal o patológica. “Hay pacientes que tienen trastornos en estas células y, de esta forma, podemos ver si se están produciendo en alguna zona concreta del cuerpo”, añade Richter.
El nacimiento de la gammagrafía supuso un gran avance para la medicina nuclear. Antes de que llegaran técnicas más modernas, el número de exploraciones anuales que se llevaban a cabo en España con estos métodos era de 1.750.000, según los datos de Richter. Pero, lo mejor estaba todavía por llegar.
Y entonces llegó el PET
La revolución para la medicina nuclear llegó, en opinión de Richter y Vallejo, con el desarrollo del PET (del inglés Positron Emission Tomography, tomografía por emisión de positrones). Esta técnica ofrece unas imágenes de muy alta calidad. También permite el desarrollo de nuevos radiofármacos con isótopos como el carbono, el flúor y el nitrógeno, presentes en cualquier molécula.
Richter compara la relevancia del PET con la “revolución” que supuso el TAC (Tomografía Axial Computarizada) en el campo de la radiología. También con la aparición de las imágenes por resonancia magnética (IRM). “El gran avance para la medicina nuclear ha sido el PET, una herramienta que ha transformado muchos conceptos en oncología y neurología”, defiende. El médico sabe de lo que habla, pues estudió la tecnología PET en el hospital Hammersmith de Londres (Reino Unido), en 1988, con la intención de traer a España una tecnología que por entonces todavía era recién nacida. Entre 1995 y 1996 se instalaron las primeras máquinas en su clínica, así como en la Universidad Complutense de Madrid. La medicina nuclear estaba a punto de alcanzar el siglo XXI en nuestro país.
“En aquel momento, nadie entendía lo que era el PET: todo estaba basado en el TAC y en la resonancia”, recuerda Richter. No fue hasta que se vieron los primeros resultados cuando los clínicos “dieron sus bendiciones” a la nueva técnica, hoy convertida en “imprescindible”. El PET ha mejorado el diagnóstico del cáncer y de patologías neurológicas como las demencias y el párkinson. A principios de 2010, según datos de la SEMNIM, 70 unidades de medicina nuclear en España contaban con equipos PET o PET-TAC. Cada año se llevan a cabo unos 60.000 procedimientos diagnósticos con esta técnica.
Para detectar corazones rotos
La oncología y la neurología no son las únicas especialidades que se han beneficiado del despertar de la medicina nuclear. El médico especialista del Hospital Universitario Vall d’Hebrón de Barcelona Santiago Aguadé cuenta con más de 30 años de experiencia en otro campo: el de la cardiología nuclear. Aguadé explica que esta rama de la medicina nuclear, que de momento se utiliza solo para diagnóstico, es más compleja que la relacionada con la oncología: “Es necesario que tres especialistas trabajen juntos: un cardiólogo, un radiólogo y un médico nuclear”. Este factor, sumado a la falta de equipos, radiofármacos adecuados y profesionales especializados es la que hace, en su opinión, que la cardiología nuclear no haya explotado todo su potencial, al menos en España.
Vall d’Hebrón de Barcelona Santiago Aguadé cuenta con más de 30 años de experiencia en otro campo: el de la cardiología nuclear. Aguadé explica que esta rama de la medicina nuclear, que de momento se utiliza solo para diagnóstico, es más compleja que la relacionada con la oncología: “Es necesario que tres especialistas trabajen juntos: un cardiólogo, un radiólogo y un médico nuclear”. Este factor, sumado a la falta de equipos, radiofármacos adecuados y profesionales especializados es la que hace, en su opinión, que la cardiología nuclear no haya explotado todo su potencial, al menos en España.
Un potencial que no se debería desdeñar, pues el PET también ha tenido un gran impacto en este campo. La endocarditis protésica (infección que se produce en una prótesis que sustituye a una válvula cardíaca del corazón) se puede diagnosticar mediante una ecocardiografía transesofágica, cuya sensibilidad a la hora de detectar la patología es, según Aguadé, “de menos del 60 por ciento”. En cambio, el éxito diagnóstico al utilizar el PET “es de un 95 por ciento”.
El PET también se utiliza en cardiología nuclear para analizar a pacientes con infartos extensos y decidir si hay que revascularizarlo o no. Aguadé asegura que, para esta detección de miocardio viable, el PET es la técnica “más sensible”.
Pero, no solo de PET vive la cardiología nuclear. Aquí la gammagrafía se utiliza como “SPECT de perfusión miocárdica”, un test de provocación de isquemia para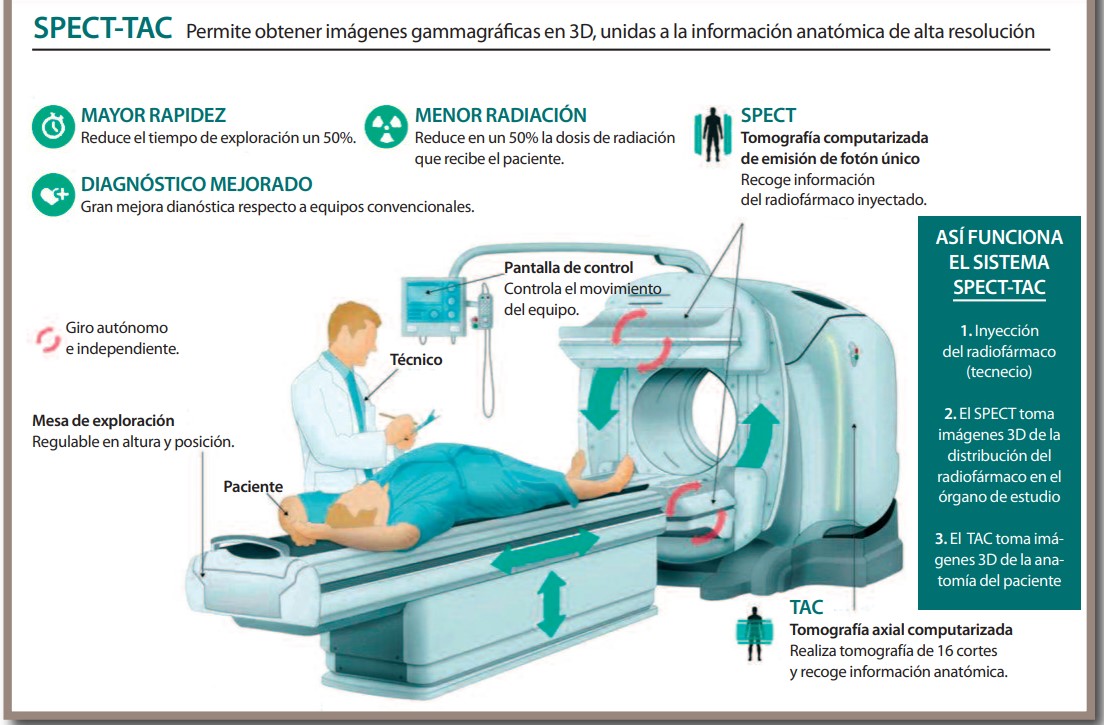 diagnosticar la angina de pecho. “Esta es la prueba más utilizada, nosotros hacemos más de 1. 500 al año”, dice el médico catalán. El motivo, según explica, es que la técnica está “toda automatizada”. Esto permite que un programa informático procese la imagen, cuando en otras técnicas como la ecocardiografía, la calidad del resultado depende “completamente” de la del operador.
diagnosticar la angina de pecho. “Esta es la prueba más utilizada, nosotros hacemos más de 1. 500 al año”, dice el médico catalán. El motivo, según explica, es que la técnica está “toda automatizada”. Esto permite que un programa informático procese la imagen, cuando en otras técnicas como la ecocardiografía, la calidad del resultado depende “completamente” de la del operador.
A pesar de todo, la cardiología nuclear se enfrenta a varias limitaciones en nuestro país. “No hay gammacámaras cardiológicas dedicadas, ni tampoco nadie dedicado en exclusiva a esta especialidad”, lamenta Aguadé. “También faltan radiofármacos de perfusión miocárdica asequibles para PET”, una prueba que por este motivo no se puede hacer en España. Para hacerla, habría que viajar hasta EE.UU.
Un acelerador de partículas
Llegados a este punto habrá quedado claro que los radiofármacos son la herramienta fundamental de la medicina nuclear, pues permiten obtener la información diagnóstica. Richter comenta que existen dos tipos: los convencionales con isótopos de emisión gamma para las gammagrafías, y los emisores de positrones que emplean los estudios PET. Encontrar nuevas moléculas marcadas con interés diagnóstico o para el tratamiento es una búsqueda sin fin para los investigadores. El marcaje con galio es uno de los últimos ejemplos: “Ofrece marcadores muy interesantes en tumores neuroendocrinos y de próstata”, comenta José Ángel Richter.
El problema de los isótopos utilizados en PET es que su vida media es muy corta, de apenas unos minutos. En otras palabras: no es posible traerlos de fuera como en el caso de otros fármacos sino que hay que producirlos en el momento. Y crear radioisótopos no es algo sencillo: “Es un problema logístico que necesita inversión, investigación y el apoyo de la industria farmacéutica”, dice Vallejo.
El servicio de medicina nuclear de Richter es uno de los 17 de España que cuentan con un ciclotrón, un acelerador de partículas al servicio de la medicina. Es una máquina muy cara que, además, necesita de personal especializado para su manejo. Las ventajas que ofrece a cambio son claras: “Nos ha permitido desarrollar radiofármacos que antes no se conocían ni aplicaban”, dice el médico. Por ejemplo el carbono 11, cuya vida media de 20 minutos obliga a aplicarlo con rapidez.
Hoy, la unidad de Richter cuenta con 22 radiofármacos que emplean tanto en clínica como investigación. Pero, ¿de verdad hacen falta tantos? “El metabolismo humano es muy complejo. Diversos tumores crecen por diversos motivos”, aclara el doctor. Esto quiere decir que el radiofármaco a emplear variará según lo que deseemos saber: cada patología tiene uno óptimo. “Si quiero ver la multiplicación de células de un tumor utilizo timidina, un nucleótido del ADN. Si quiero ver un tumor en el cerebro utilizo un aminoácido, la metionina”. Colon, mama, cerebro, próstata… cada tumor tiene un radiofármaco adecuado. Algo similar sucede con la neurología, según necesitemos ver el metabolismo de las neuronas, los depósitos de amilodes del cerebro o el metabolismo del sistema nigroestriado implicado en el párkinson.
Dos en uno: equipos multimodales
Los radiofármacos no son el único aspecto de la medicina nuclear en constante evolución. Si estos son los elementos que nos permiten obtener datos del paciente, el otro pilar de este campo son los propios equipos que detectan esa información. “Son sondas que pueden ser muy sencillas o muy complejas, desde gammacámaras a la tecnología PET de los últimos años”, explica Richter.
La última tendencia en este sentido son los ‘equipos multimodales’, un baile de siglas con un único fin: conseguir toda la información posible sobre lo que pasa en el interior del paciente. Richter explica su importancia: “En medicina las enfermedades se conocen por los cambios anatómicos, histológicos y metabólicos que provocan. Para entender bien una patología es necesario tener la información de uno, dos o incluso tres de los factores”.
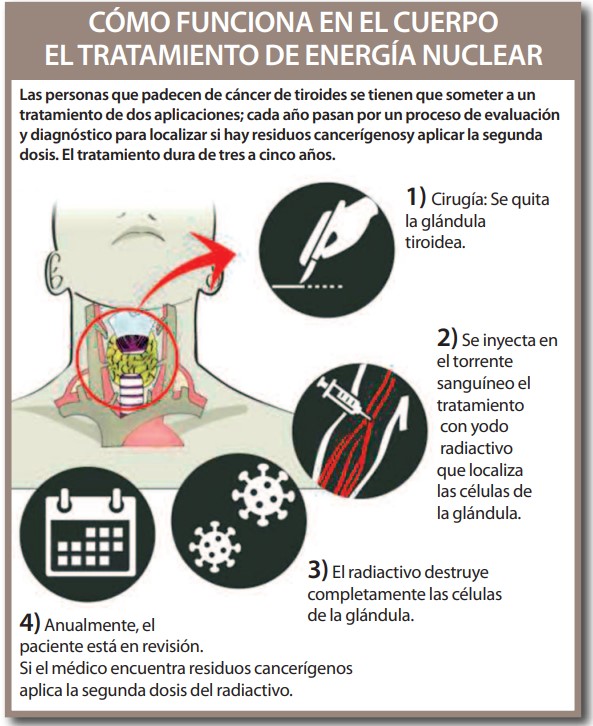
Es aquí donde entran en juego los equipos multimodales, que permiten obtener en una misma exploración la información anatómica y molecular del paciente. Por ejemplo, las técnicas se han ‘fusionado’ con la tomografía computada (CT, del inglés ‘computed tomography) para dar lugar al PET-CT y al SPECT-CT.
El futuro de la medicina nuclear La medicina nuclear no es nueva pero, aunque el PET supuso una revolución, no significa que haya llegado a su cenit. Uno de los últimos términos incorporados a este campo es el de la ‘teragnosis’ (del latín: ‘tera, tratamiento; ‘gnosis’, conocimiento). “Hoy en día muchas de las técnicas que se usan para diagnósticos se pueden aplicar también por la línea terapéutica”, aclara Richter. Vallejo, por su parte, considera la aplicación terapéutica de estas técnicas “la vía fundamental” en el desarrollo actual de este campo.
El objetivo de la teragnosis es lograr diagnóstico y tratamiento con la misma molécula en dos fases distintas. “Primero hago el diagnóstico con un isótopo para detectar la enfermedad y saber que puedo ‘verla’ con esa molécula y luego utilizo esa misma molécula con un isótopo terapéutico”, comenta Richter. “Lo único que cambia es el isótopo: uno de baja energía y otro más ‘agresivo’ para cargarse la célula”, aclara Vallejo. Un ‘dos por uno’ con el que el paciente puede beneficiarse de las dos caras de la medicina molecular.
En los últimos años se ha hablado mucho de la genómica y la proteómica. Más joven es la ‘radiómica’, un nuevo campo de estudio todavía en vías de investigación. Esta permitirá cuantificar las imágenes obtenidas a través de nuevos soft-wares más sensibles. El resultado, será obtener una información mucho más rica y precisa de las patologías. Una cantidad de datos que hará que los que se obtienen hoy en día queden superados.
La faceta terapéutica de la medicina nuclearse centra en la oncología, pero no excluye otras enfermedades como el hipertiroidismo e incluso algunas patologías articulares. Juan Antonio Vallejo médico del Hospital Universitario Reina Sofía de Córdoba, Juan Antonio Vallejo, adelanta los próximos años: “Habrá nuevas dianas terapéuticas, por ejemplo en cáncer de próstata, donde el trazador PCNA va a cambiar el escenario de esta enfermedad”. También explica que se está trabajando con nuevos receptores que aumenten la selectividad y seguridad del tratamiento.
No olvidemos la investigación básica
Los radiofármacos y las imágenes PET utilizados por la medicina nuclear no solo tienen valor en clínica: también se utilizan en investigación básica. Se trata de herramientas poderosas con las que los científicos pueden, por ejemplo, desarrollar modelos que ayuden a entender algunas enfermedades que nada tienen que ver con el cáncer. Uno de los últimos ejemplos en España ha sido el estudio llevado a cabo por investigadores del Centro Nacional de Aceleradores (CNA) y el Hospital Universitario Virgen del Rocío (Sevilla), cuyos resultados fueron publicados hace unos meses en la revista Applied Radiation and Isotopes. En él, se utilizó la técnica PET para estudiar la hemorragia subaracnoidea, una enfermedad grave con una mortalidad elevada.
Los investigadores utilizaron el radiofármaco [18F]FMISO, capaz de detectar células que tienen una concentración baja de oxígeno, en ratas a las que se les había inducido una hemorragia subaracnoidea. Gracias al PET, pudieron encontrar “las zonas viables, que están ‘adormiladas’ pero son recuperables”, según explica la radiofarmacéutica de la Universidad de Sevilla y coautora del estudio, Laura Fernández. Aunque la intención de este estudio no es lograr un mejor diagnóstico de esta enfermedad en seres humanos, sí permitirá comprobar la eficacia de fármacos en un modelo experimental llevado a cabo con ratas. Algo que, a largo plazo, también podría mejorar el manejo de los pacientes.

 Descarga la revista completa
Descarga la revista completa